Contoh Soal Ide Laju Reaksi – Reaksi kimia ada yang berjalan cepat, ada juga yang berjalan lambat. Ketika akan membakar kayu, kita harus memotong kayu hingga menjadi bongkahan kecil, tujuanya untuk mempermudah reaksi pembakaran.
Kembang api akan menyalan dengan cepat serta cepat habis setelah kita nyalakan. Apabila menyulut korek api, pentol korek api juga akan cepat habis terbakar dibandingkan dengan batang kayu korek api tersebut.
Selain itu, penambahan soda kue dalam sebuah adonan roti, juga akan membantu adonan menjadi lebih cepat mengembang. Hal tersebut disebut dengan kecepatan yang terjadi dalam sebuah reaksi yang dikenal dengan laju reaksi.
Artinya laju reaksi adalah kecepatan atau banyaknya reaksi kimia yang terjadi dalam satuan waktu. Laju reaksi ini dapat dihitung dengan rumus laju reaksi untuk dapat menentukan kecepatan, waktu dan laju reaksi suatu reaksi kimia tertentu.
Contoh Soal Ide Laju Reaksi beserta Pengertian dan Rumus

Nah, pada kesempatan kali ini inspired2write akan menyajikan informasi tentang contoh soal ide laju reaksi. Contoh soal laju reaksi bisa jadi soal latihan untuk dapat menentukan laju reaksi suatu reaksi kimia. Namun sebelum itu, untuk lebih paham tentang laju reaksi, ada baiknya simak pengertian laju reaksi di bawah ini terlebih dahulu.
Pengertian Laju Reaksi
Laju reaksi merupakan banyaknya reaksi kimia yang berlangsung per satuan waktu. Laju reaksi menyatakan banyakanya mol zat terlarut (molaritas) dalam reaksi yang dihasilkan tiap detik reaksi.
Dari pengertian di atas, misalkan :
aA + bB → cC + dD
- a, b, c, dan d yaitu koefisien reaksi.
- A, B, C, dan D yaitu zat-zat yang terlibat reaksi.
- [A], [B], [C], dan [D] yaitu konsentrasi zat-zat tersebut.
Maka, laju reaksi dalam sebuah sistem dapat dinyatakan.

Bertambahnya waktu jumlah molekul reaktan A dan B akan berkurang, sedangkan jumlah molekul C dan D akan bertambah. Kemudian, hukum laju reaksi akan menyatakan sebuah persamaan yang memperlihatkan keterkaitan atau hubungan antara laju reaksi dengan konsentrasi pereaksinya.
Faktor yang Mempengaruhi Laju Reaksi
Faktor-faktor yang memungkinkan mengontrol laju reaksi, memperlambat reaksi ataupun meningkatkan laju reaksi yaitu sebagai berikut.
- Konsentrasi
Semakin tinggi konsentrasi, maka tumbukan antar molekul semakin sering terjadi dan reaksi akan berlangsung lebih cepat. - Luas Permukaan Bidang Sentuh
Semakin luas permukaan partikel, maka akan semakin tinggi frekuensi tumbukan sehingga reaksi dapat berlangsung lebih cepat. - Temperatur
Semakin tinggi temperatur suhu, maka laju reaksi akan semakin cepat bereaksi. - Katalisator
Zat yang dapat mempercepat reaksi dengan cara menurunkan energi aktivitas.
Rumus Laju Reaksi
Berdasarkan persamaan di atas, maka rumus laju reaksi sebagai berikut.
v = k [A]x[B]y
Keterangan :
- v = laju reaksi
- k = Konstanta laju reaksi
- x = orde reaksi terhadap A
- y = orde reaksi terhadap B
- x + y = orde reaksi total
Contoh Soal Ide Laju Reaksi
Setelah mengetahui pengertian dan rumus laju reaksi, untuk lebih paham tentang laju reaksi, silahkan simak contoh soal di bawah ini.
A. Soal Laju Reaksi Pilihan Ganda
1. Laju reaksi : 2A + 2B → 3C + D dapat dinyatakan sebagai laju reaksi bertambahnya konsentrasi…
a). A tiap satuan waktu
b). B tiap satuan waktu
c). C tiap satuan waktu
d). B dan C tiap satuan waktu
e). A dan B tiap satuan waktu
Jawaban : C
2. Dalam wadah tertutup, penguraian sulfuril klorida (SO2CI2) menurut reaksi : SO2CI2(g) → SO2(g) + CI2(g) mempunyai laju r = k [SO2CI2]. Pernyataan yang benar untuk reaksi tersebut adalah…
a). Laju reaksi akan semakin cepat selama reaksi berlangsung
b). Satuan konstantan laju reaksi (k) adalah M-1S-1
c). Laju reaksi menjadi lebih cepat jika volume wadah diperbesar
d). Konsentrasi SO2 akan bertambah dengan laju sebesar r
e). Konsentrasi SO2CI2 akan bertambah dengan laju sebesar r
Jawaban : D
3. Berikut beberapa faktor yang mempengaruhi laju reaksi, kecuali…
a). Konsentrasi
b). Katalis
c). Luas permukaan
d). Suhu
e). Tekanan parsial
Jawaban : E
4. Data hasil percobaan : A + B → C sebagai berikut :
| No | Bentuk Zat A | Konsentrasi (mol/L) | Suhu (ºC) | Waktu (detik) |
|---|---|---|---|---|
| 1 | Serbuk | 0,1 | 25 | 2 |
| 2 | Larutan | 0,1 | 25 | 3 |
| 3 | Kepingan | 0,1 | 25 | 3 |
| 4 | Larutan | 0,2 | 25 | 1,5 |
| 5 | Larutan | 0,1 | 35 | 1,5 |
Pada percobaan 1 dan 3, kecepatan reaksi dipengaruhi oleh…
a). Luas permukaan
b). Konsentrasi
c). Katalis
d). Sifat Zat
e). Suhu
Jawaban : A
5. Data percobaan :
| No | Logam Mg | [HCI] | Suhu |
|---|---|---|---|
| 1 | Batangan | 0,1 M | 20ºC |
| 2 | Butiran | 0,1 M | 20ºC |
| 3 | Butiran | 0,1 M | 30ºC |
| 4 | Butiran | 0,2 M | 30ºC |
| 5 | Batangan | 0,2 M | 30ºC |
Laju reaksi yang paling cepat terjadi pada nomor…
a). 2
b). 4
c). 1
d). 5
e). 3
Jawaban : B
B. Soal Laju Reaksi Essay
1. Kedalam sebuah ruangan yang memiliki volume 2 liter, dimasukan 4 mol has HI yang selanjutnya terurai menjadi gas H2 dan I2. Setelah selama 5 detik, dalam ruang tersebut terdapat 1 mol gas H2. Tentukan laju reaksi pembentukan gas H2 dan laju reaksi gas HI berturut-turut yaitu…

2. Suatu reaksi kimia berlangsung pada suhu 30ºC memerlukan waktu 40 detik. Setiap suhu naik 10ºC, reaksi akan lebih cepat 2x dari semula. Berapa waktu yang dibutuhkan jika suhu naik menjadi 50ºC…

3. Jika reaksi N2 + H2 → NH3, kecepatan reaksi berdasarkan N2 dinyatakan sebagai xN dan berdasarkan H2 dinyatakan xH, maka persamaan laju reaksi yang tepat yaitu…
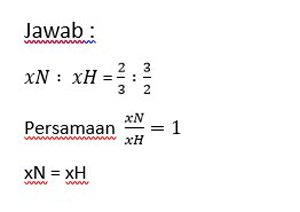
Download Soal Ide Laju Reaksi
Nah, untuk contoh soal lebih lengkap tentang laju reaksi, silahkan anda download contoh soal laju reaksi pada link di bawah ini.
Itulah beberapa contoh soal ide laju reaksi yang dapat inspired2write.com sajikan untuk anda. Untuk menentukan nilai laju reaksi, sebenarnya tak sesulit SOAL PERSAMAAN LOGARITMA. Demikian informasi yang dapat inspired2write sajikan, semoga informasi di atas bermanfaat.